
Toute effraction cutanée entraîne une cascade de réactions biologiques dans la peau dont le but est de rétablir au plus vite et au mieux ses fonctions. La cicatrisation cutanée est malheureusement souvent un processus complexe et imprévisible, et il n’est pas rare de voir se développer des processus cicatriciels défectueux à type de cicatrices hypertrophiques ou chéloïdes.
Ainsi, tout acte chirurgical ou d’agression physique sur la peau soulève le délicat problème de sa cicatrisation. Elle est imprévisible et nécessite la prise en compte d’un risque de développer des cicatrices hypertrophiques ou des chéloïdes surtout pour les personnes à risque.
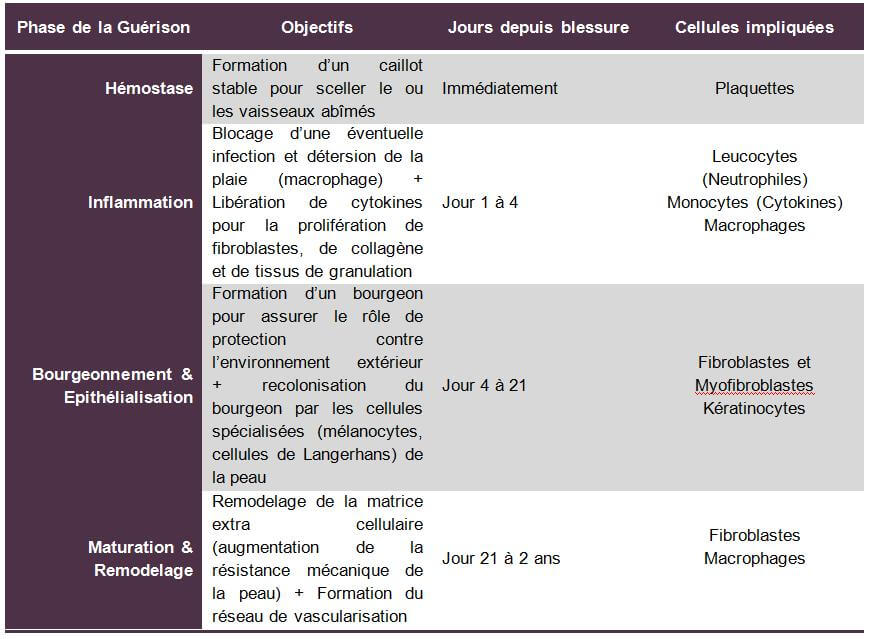
Les différentes phases de la cicatrisation
La peau est l’enveloppe visible de notre corps. Elle joue un rôle vital, agissant comme une barrière et exerçant une influence régulatrice entre l’environnement extérieur et le milieu interne. En présence de plaie aiguë ou chronique, l’organisme déclenche un processus complexe de cicatrisation dont le seul objectif est d’aboutir à la fermeture de la peau lésée. Nous distinguons 4 phases pour aboutir à cet objectif de cicatrisation :
La phase vasculaire ou l’hémostase
Après une agression physique de la peau, la plaquette sanguine est la cellule qui vient sceller les vaisseaux sanguins abîmés. Elles secrètent des substances vasoconstrictrices (pressurisation) pour arrêter le saignement. Le rôle de ces plaquettes est d’arriver rapidement à la formation de caillot stable pour sceller le vaisseau abîmé.
L’adénosine diphosphate (nucléotide) s’écoulant des tissus abîmés permet aux plaquettes de se lier entre elles et s’accrochent au collagène exposé. Les plaquettes permettent la sécrétion de thrombine puis de fibrines qui viennent renforcer l’agrégation plaquettaire produisant ainsi le caillot stable capable de sceller le vaisseau ou les vaisseaux abîmés.
La phase vasculaire se produit dans les minutes qui suivent l’agression de la peau.
La phase inflammatoire
A la suite de la phase vasculaire et une fois que le caillot stable jouant un rôle de matrice extracellulaire temporaire est formé, débute la phase inflammatoire qui dure de quelques heures à quelques jours selon la gravité de la plaie.
Cette phase débute par un phénomène de vasodilatation (dépressurisation) permettant ainsi aux cellules circulantes d’atteindre la plaie. Des leucocytes arrivent ainsi rapidement au niveau de la plaie et secrètent des enzymes favorisant la pénétration de cellules spécialisées dans la plaie. Ensuite, grâce à l’action des leucocytes favorisant la pénétration cellulaire au niveau de la plaie, des monocytes se fixes sur les cellules endothéliales et migrent dans la plaie. Une fois dans le milieu tissulaire, ils se différencient en macrophages et adhérent aux protéines de la matrice extracellulaire. Les macrophages jouent un rôle anti infectieux et de détersion locale grâce à leurs capacités de phagocytose, ils participent également au remodelage matriciel. Ces mêmes monocytes jouent ensuite un rôle primordial en libérant des cytokines (Insuline Grow Factor 1, Transforming Grow Factor et Tumor Necrosis Factor). Ces substances présentent la propriété d’amplifier la réponse inflammatoire et stimulent la prolifération de fibroblastes, de collagène et tissus de granulation. Dans les 72H qui suivent l’apparition de la plaie, les macrophages deviennent prédominant en nombre et en activité. Vers le 7ème jour, peu de cellules inflammatoires sont recensées au niveau de la plaie et les fibroblastes deviennent le type cellulaire prédominant.
La phase de bourgeonnement et d’épithélialisation
Après l’élimination des déchets tissulaires par les macrophages et la mise en place d’une matrice extracellulaire temporaire (caillot stable), la reconstitution d’une nouvelle matrice cellulaire définitive va s’opérer grâce au bourgeonnement. Cette phase débute 4 jours après la survenue de la plaie et peut durer jusqu’à 21 jours pour les grandes plaies. La cicatrice a la forme d’un tissu rouge et rugueux au toucher. Les fibroblastes vont jouer le rôle d’ossature à cette matrice en sécrétant du collagène (type I et III) qui agit comme une charpente sur laquelle les cellules régénérées vont se greffer. Les cellules endothéliales (kératinocytes) et de fibroblastes vont proliférer ainsi jusqu’à ce que de nouveaux vaisseaux sanguins soient formés et qu’une nouvelle matrice extra cellulaire soit en place. Par la suite, les fibroblastes vont se transformer en cellules musculaires lisses pour devenir des myofibroblastes capables de se contracter et de solidifier le bourgeon ainsi formé. Les kératinocytes (cellules endothéliales) vont se différencier pour former par la suite la couche extérieure protectrice de la peau : la couche cornée. La colonisation de la nouvelle peau ainsi reconstituée par des cellules spécialisées telles que les cellules de Langerhans ou les mélanocytes peut démarrer.
La phase de maturation & remodelage
C’est la phase la plus longue de la cicatrisation. Elle peut durer de quelques semaines à quelques mois. Elle débute par le remodelage de la matrice cellulaire avec une première phase inflammatoire et proliférative qui peut durer 2 mois après la formation du bourgeon. Ensuite, le bourgeon se raréfie en fibroblastes et une structure collagénique apparaît avec un réseau de vascularisation qui s’organise. La résistance mécanique de la cicatrice augmente et atteint 90% de sa force finale vers la 6ème semaine. De nouveaux composés sont par la suite sécrétés pour accroître la densité de la matrice et sa stabilité.
L’âge, les forces de tension, la pression influencent la synthèse et l’organisation des molécules de collagène. Les cicatrices sont néanmoins, dans tous les cas, moins résistantes et moins élastiques que la peau normale, en partie à cause d’un certain déficit en élastine.
Tableau des 4 phases de la cicatrisation
Le traitement d’une cicatrice
La majeure partie des plaies aiguës (traumatiques, brûlures superficielles, chirurgicales…) évolue vers un processus de cicatrisation normale et dont le délai de cicatrisation est fonction de la superficie, de la profondeur et du terrain.
Les plaies chroniques (escarres, ulcères, lésions vasculaires du diabétique…) évoluent vers un processus de cicatrisation compliqué ou la prévention demeure le meilleur traitement. La gestion et le suivi de plaies (chroniques) doivent se faire sous suivi médical compte tenu des grands risques de nécrose.
Plusieurs études ont démontrées que la cicatrisation est plus rapide en milieu humide qu’en milieu sec : une plaie porcine de 2.5 cm² sous pansement occlusif maintenant une zone humide atteint 90% de sa cicatrisation en 3 jours, alors que la cicatrisation n’est que de 50% pour une plaie séchée à l’air libre et atteint même que 18% pour une plaie traitée avec un courant d’air chaud.
Exclusion des antiseptiques & antibiotiques
La première étape de traitement d’une plaie aiguë est d’exclure tout usage systématique d’antiseptiques ou d’antibiotiques locaux.
L’intérêt d’une utilisation d’antiseptiques sur peau lésée est minime par rapport à leurs effets secondaires potentiels (toxicité systémique, sélection des germes, allergies, causticité…). Un lavage au sérum physiologique ou à l’eau claire et au savon est largement suffisant.
Pour ce qui est des antibiotiques, il faut savoir que la flore bactérienne, sauf excès, n’est pas délétère, voire même participe à la détersion ; à la phase de détersion, il s’agit essentiellement de bactéries Gram négatif ou d’anaérobies, qui diminueront spontanément avec la cicatrisation, pour être remplacés par des coccis Gram positif aux stades de bourgeonnement et épidermisation. Les antibiotiques locaux sont donc généralement inutiles ; seule la sulfadiazine argentique continue à être régulièrement utilisée, en particulier dans les Centres de Traitement des Brûlés.
Maintien du milieu humide de la peau lésée : le pansement
L’exsudation plasmatique (fuite du plasma en cas de coupure ou de blessure de la peau) initiale constitue pour le fibroblaste et les cellules de l’épiderme un excellent milieu de culture qu’il ne faut surtout pas perturber par une attitude trop agressive (utilisation de certains antiseptiques ou pansements trop agressifs).
Les pansements, d’une grande diversité, sont les meilleurs atouts pour favoriser ou du moins ne pas perturber le processus de cicatrisation, de protéger la plaie, de contrôler la douleur, d’être perméable aux gaz, d’être bien toléré par la peau, d’être facile à changer, confortable, avec un bénéfice coût/efficacité acceptable.
Les pansements sont classés en 3 grandes catégories que sont :
- Les pansements secs (compresses, pansements prêts à l’emploi)
- Les pansements humides (la majorité des pansements primaires)
- Et les pansements moléculaires et cellulaires (transition avec les greffe dermo-épidermique)
A ce jour, les différents pansements existants sur le marché sont répartis suivant les grandes familles suivantes :
- Les hydrocolloïdes utilisés depuis la phase de détersion jusqu’à la phase de cicatrisation sur des plaies exsudatives
- Les hydrogels qui ont une utilisation comparable aux hydrocolloïdes mais plus actifs sur les plaques de nécrose
- Les hydrocellulaires sont utilisés dans les plaies peu ou moyennement exsudatives depuis la phase détersion jusqu’à la phase de cicatrisation
- Les alginates ont une grande capacité d’absorption et accélèrent le processus de détersion. Ils ont un pouvoir hémostatique et antibactérien
- Les hydrofibres sont proches des hydrocolloïdes et des alginates. Elles peuvent être utilisées depuis la phase de détersion jusqu’à la phase de cicatrisation. Elles se transforment par leur qualité hydrophile en gel au contact des exsudats.
- Les pansements au charbon surtout dans les plaies chroniques malodorantes ou infectées
Les pansements hydrocolloïdes
Ils sont tous dérivés d’un polymère absorbant, la carboxy-méthyl-cellulose (CMC). Ils ont des capacités absorbantes importantes. Leur intérêt repose sur leur simplicité d’utilisation, leur durée de vie d’au moins 2 jours en fonction de l’exsudat. Leur inconvénient est qu’ils se transforment au contact de la plaie en un gel malodorant en dehors de toute infection, qui peut couler hors du pansement irritant la peau autour, inquiétant le malade… Ils favorisent donc parfois la macération, mais aussi un hyper bourgeonnement, réductible par des corticoïdes locaux, et beaucoup plus rarement un eczéma de contact.
Les pansements hydrocellulaires
Les hydrocellulaires plus récemment mis sur le marché, évitent les inconvénients des pansements hydrocolloïdes tout en absorbant et maintenant un milieu humide : ils sont donc particulièrement intéressants dans les plaies en partie détergées et modérément exsudatives.
Les pansements hydrogels
Les hydrogels se composent de 80% d’eau : destinés aux plaies sèches, nécrotiques, ils sont en fait plus humidifiant qu’absorbant. Ils nécessitent un pansement secondaire peu absorbant, comme un film ou un hydrocellulaire, pour que leur eau aille dans la nécrose… et pas dans la compresse !
Les pansements alginates et hydrofibres
Ces 2 types de pansements présentent de grande capacité d’absorption. Ils se présentent sous forme de compresses ou de mèches, qui se transforment en gel au contact des exsudats.
Les alginates sont des extraits d’algues marines très absorbants (10 à 15 fois leur poids) et aux capacités hémostatiques. Ils détergent la plaie (débris captés par le gel) et contrôlent la prolifération bactérienne par piégeage physique ; ils ne se délitent pas dans la plaie et son retrait est non douloureux. Ils ne sont pas indiqués sur des plaies non exsudative.
Les hydrofibres sont des pansements à base de fibre de CMC absorbant 30 fois son poids, de capacité d’absorption supérieure aux alginates et donc indiqué dans les plaies exsudatives, où il se transforme en une sorte de gel.
L’utilisation de ces 2 types de pansements ne doit pas être poursuivie lorsque l’écoulement se réduit car ils deviennent très douloureux.
Les pansements au charbon
Ce sont des pansements à base d’un tricot de charbon imprégnés d’ions argentiques ou non. Ils limitent la prolifération bactérienne et les odeurs. Ils présentent l’inconvénient d’être peut absorbants et ils sont indiqués pour les plaies fibrineuses, infectées et malodorantes (plaies cancéreuses ou du diabétique). Peu adhérents et modérément absorbants, leur utilisation nécessite un pansement secondaire pour assurer l’absorption et le maintien.
LES CICATRICES HYPERTROPHIQUES ET CHELOÏDIENNES
Les chéloïdes et les cicatrices hypertrophiques sont des tumeurs intradermiques correspondant à une réponse inadéquate du tissu conjonctif à un traumatisme (brûlures, cicatrices d’acné, vaccination, piqûres d’insectes, blessures…).
La chéloïde se caractérise par une masse intradermique ferme à la palpation, pouvant devenir prurigineuse et/ou hypersensible et dont l’épiderme est aminci, lisse et tendu. Elle apparaît généralement 3 à 6 mois après le traumatisme, s’étend souvent en périphérie avec un aspect en « pattes de crabe » et dépasse alors les limites de la lésion initiale. Les lésions initiales sont érythémateuses ; elles évoluent vers une couleur brunâtre avant de pâlir. Elles se distribuent préférentiellement au cou, aux lobes des oreilles, aux épaules, aux bras et plus rarement aux parties génitales, paumes, plantes et muqueuses. Il existe aussi des chéloïdes spontanées chez le patient à peau noire, principalement.
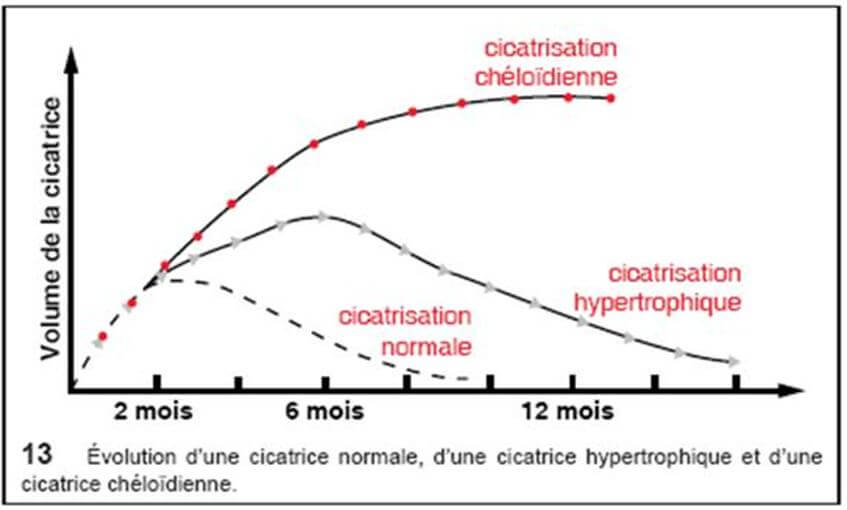
La cicatrice hypertrophique, présente des bords parallèles, ne s’étend pas en périphérie ; elle apparaît dans le mois qui suit le traumatisme et évolue spontanément vers une régression en 12 à 18 mois.
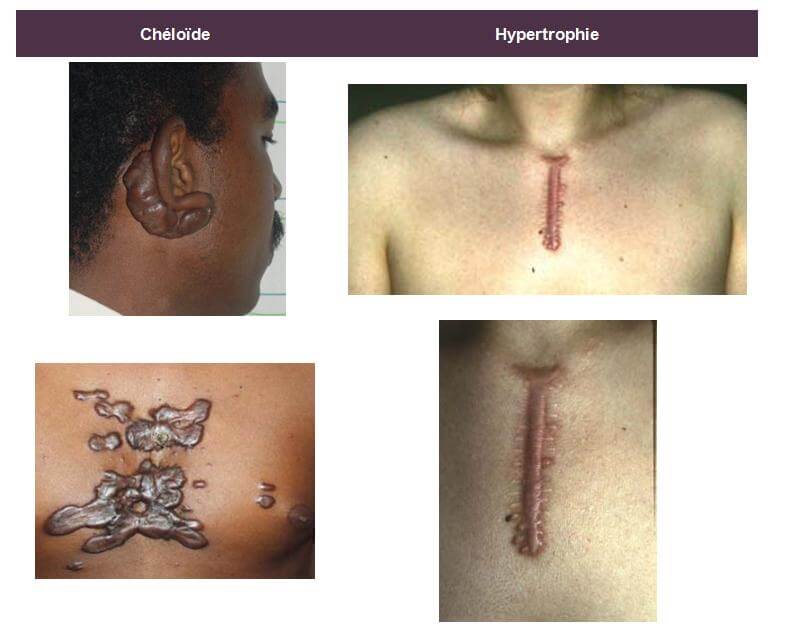
Les chéloïdes peuvent toucher toutes les ethnies mais présentent une prévalence supérieure pour les peaux génétiquement pigmentées (noirs africains et asiatiques) avec un taux de plus de 16% chez ce type de population.
Les chéloïdes
La cicatrice chéloïdienne se définit comme une prolifération fibreuse d’origine dermique ayant des prolongements radiculaires en forme de « pinces d’écrevisse » évoluant depuis plus de deux ans. C’est une lésion très fréquente dans la race noire et qui constitue un véritable cauchemar pour les jeunes filles, surtout lorsqu’elle siège au niveau des zones exposées du corps. Les facteurs de risque des chéloïdes sont la pigmentation forte de la peau (personne noire et mate), le groupe sanguin (notamment les personnes du groupe A), l’âge (période de puberté jusqu’à 30 ans) et la localisation de l’agression physique de la peau (sternum, lobe de l’oreille, partie inférieure du visage, moignon de l’épaule, cou, pubis), l’exposition solaire des cicatrices.
Nous avons vu plus en haut que la cicatrisation se déroulait en 4 phases que sont : l’ « Hémostase », l ’ « Inflammation », le « Bourgeonnement & l’Epithélialisation » et enfin « La Maturation et le Remodelage ». Dans une chéloïde, la phase de « Bourgeonnement & Epithélialisation » également appelée phase « Proliférative » voit sa durée explosée et passe de 21 jours au maximum sur une cicatrice normale à plusieurs mois sur une cicatrice chéloïdienne. Cette hyperactivité de fibroblastes va engendrer une surproduction de collagène. L’absence de collagénases (enzyme responsable de la destruction des collagènes) conjuguée à cette surproduction de collagène va entraîner une boursouflure au niveau de la zone de cicatrice. Les fibres de collagène ainsi synthétisées sont 20 fois plus abondantes que dans la peau normale.
Même si la formation d’une cicatrice chéloïdienne soulève beaucoup de controverses, le TGF-β semble être le facteur principal de cette prolifération anormale de fibroblastes et de la production de collagène. Cette production anormale de TGF-β est associée à une concentration anormalement élevée de lymphocytes T, de macrophages et de cellules de Langerhans issues de la différenciation des kératinocytes.
Traitement des chéloïdes
La cicatrisation chéloïdienne est une pathologie spécifique à l’être humain (aucun animal ne développe des chéloïdes). Cela explique donc les difficultés de compréhension de la physiopathologie de cette anomalie de la cicatrisation pour laquelle n’existe pas de modèle animal.
Bien que certains traitements permettent d’en atténuer la gravité, il n’existe pour l’heure pas de solution thérapeutique satisfaisante pour cette pathologie.
Le traitement des chéloïdes doit être au mieux préventif, dans le cas fréquent des chéloïdes post chirurgicales. Après l’apparition de la chéloïde, le traitement le plus efficace résulte généralement de la combinaison de plusieurs procédures médicales (corticothérapie), chirurgicales et radio thérapeutiques complémentaires.
Par ailleurs, le diagnostic de la cicatrice chéloïde, duquel va dépendre la réponse thérapeutique, pose problème. Son homologie d’aspect avec la cicatrice hypertrophique rend difficile la prise de décision sur la voie thérapeutique dans la phase précoce, là où son évolution pourrait être le plus efficacement contrariée.
Les corticostéroïdes
L’injection intra-lésionnelle de corticostéroïdes constitue actuellement le traitement de choix des chéloïdes. Ils agissent sur la synthèse du collagène et des glycosaminoglycans par diminution du processus inflammatoire de la plaie, réduction de la prolifération des fibroblastes et par un effet hypoxique ; ils diminuent les inhibiteurs des protéases plasmatiques permettant la dégradation du collagène par les collagénases ; ils inhibent la croissance des fibroblastes, sont responsables de leur dégénérescence et diminuent le taux de TGF-β. Ils améliorent ainsi l’aspect de la lésion sans véritablement la faire disparaître. L’acétonide de triamcinolone est la molécule de référence à la dose de 10 à 40 mg/ml. Les injections, douloureuses, sont réalisées toutes les 3 semaines ; 2 à 3 injections sont généralement nécessaires. Pour augmenter l’efficacité des corticostéroïdes, on peut y associer la cryothérapie ou la chirurgie.
La cryothérapie
La cryothérapie agit sur la chéloïde par modification de la micro circulation entraînant une ischémie, une destruction cellulaire directe et une nécrose tissulaire.
La lésion sera refroidie pendant 30 secondes 2 à 3 fois par séance et cela à intervalles réguliers. Les chéloïdes fortement vascularisées et présentes depuis moins de 12 mois représentent l’indication principale de ce type de traitement.
La radiothérapie
La radiothérapie interstitielle postopératoire est utilisée principalement dans les cas réfractaires. Des aiguilles de curiethérapie sont placées pendant 24 à 48 heures dans la cicatrice d’exérèse de la chéloïde pour prévenir sa récidive. La radiothérapie sans excision préalable est utilisée avec des résultats beaucoup plus controversés. Les effets secondaires principaux sont l’hyperpigmentation, le prurit et l’érythème. Le potentiel carcinogène à long terme limite son utilisation.
La pressothérapie
La pressothérapie est principalement utilisée dans la prévention des cicatrices hypertrophiques chez les brûlés. La compression externe doit être réalisée 12 à 24 heures/jour pendant un minimum de 9 mois. La pression sur le tissu provoque une ischémie qui diminue le métabolisme tissulaire et augmente la dégradation du collagène par libération de collagénases lors de l’apoptose des fibroblastes.
Le gel de silicone topique
Les pansements de gel de silicone sont principalement employés pour la prévention mais peuvent aussi être utilisés en complément du traitement des cicatrices hypertrophiques et des chéloïdes.
On pense que les pansements agiraient plus par hydratation et occlusion que par la silicone elle-même.
Le laser
Les lasers CO2 sont déconseillés sur les chéloïdes car le risque de récidive est trop élevé. Au contraire, le laser à colorant pulsé et sur peau blanche peut être utilisé pour les chéloïdes récentes, richement vascularisées. Il agit sur l’érythème, l’épaisseur de la cicatrice et le prurit.
La chéloïde sur peau noire, compte tenu de la forte présence d’eumélanine (pigments noirs) est difficilement traitable au laser à cause d’une très forte absorption de la plupart des longueurs d’onde.
Conclusion sur les traitements
Il n’existe pas de véritable consensus pour la prise en charge des chéloïdes. Le premier choix reste l’injection intra lésionnelle de corticoïdes. Si ce traitement est inefficace, la chirurgie intra marginale avec ou sans injection de corticoïdes ou d’autres molécules peut être tentée. La radiothérapie doit être réservée aux cas les plus difficiles. La pressothérapie et les gels de silicone seront surtout utilisés à titre préventif.
D’une manière générale, la seule façon de se prémunir contre les chéloïdes, surtout pour les personnes à risque notamment la population noire, est d’éviter tout acte d’agression de la peau non utile surtout au niveau du sternum, du lobe de l’oreille, de la partie inférieure du visage, du moignon de l’épaule, du cou et du pubis





